SN2 reakce
Reakce SN 2 (známá také jako bimolekulární nukleofilní substituce) je substituční reakce v organické chemii. Jedná se o typ nukleofilní substituce, při níž osamělý pár nukleofilu napadá elektrofilní centrum s nedostatkem elektronů a váže se na něj. Tím se vytlačí další skupina, která se nazývá "odcházející skupina". Přicházející skupina tedy v jednom kroku nahradí odcházející skupinu. Protože se na pomalém, rychlost určujícím kroku reakce podílejí dva reagující druhy, vede to k názvu bimolekulární nukleofilní substituce nebo SN 2. Mezi anorganickými chemiky je reakce SN 2 často známá jako záměnný mechanismus.
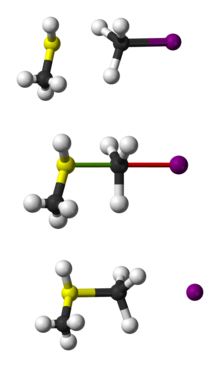
Kuličkové znázornění SN 2 reakce CH3 SH s CH3 I
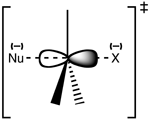
Struktura přechodového stavu SN 2
Mechanismus reakce
Reakce nejčastěji probíhá na alifatickém sp3 uhlíkovém centru, ke kterému je připojena elektronegativní, stabilní odcházející skupina - "X" - často halogenidový atom. K přerušení vazby C-X a vzniku nové vazby C-Nu dochází současně za vzniku přechodného stavu, v němž je nukleofilně napadený uhlík pentakoordinovaný a přibližně sp2 hybridizovaný. Nukleofil útočí na uhlík pod úhlem 180° vůči odcházející skupině, protože to poskytuje nejlepší překrytí mezi osamělým párem nukleofilu a antivazebným orbitalem C-X σ*. Opouštějící skupina je pak vytlačena z opačné strany a vzniká produkt.
Pokud je substrát, na který je nukleofilně útočeno, chirální, může to vést, i když ne nutně, k inverzi stereochemie, tzv. Waldenově inverzi.
V příkladu reakce SN 2 dochází k útoku OH −(nukleofil) na bromoethan (elektrofil) za vzniku ethanolu, přičemž bromid je vyloučen jako odcházející skupina:
Reakce SN 2 probíhá, pokud není zadní cesta útoku blokována jinými atomy v molekule (stericky brání substituenty na substrátu). Tento mechanismus tedy obvykle probíhá na neblokovaném primárním uhlíkovém centru. Pokud je na substrátu v blízkosti odcházející skupiny sterická překážka, např. na terciárním uhlíkovém centru, substituce bude probíhat spíše mechanismem SN 1 než SN 2 (SN 1 by byl pravděpodobnější také u blokovaných molekul, protože by mohl vzniknout dostatečně stabilní karbokační intermediát).
V koordinační chemii probíhá asociativní substituce podobným mechanismem jako SN 2.
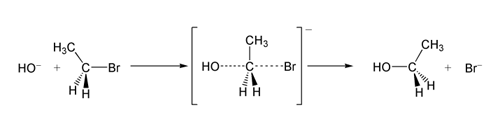
SN 2 reakce bromoetanu s hydroxidovým iontem.
Faktory ovlivňující rychlost reakce
Rychlost reakce ovlivňují čtyři faktory:
- Substrát. Substrát hraje nejdůležitější roli při určování rychlosti reakce. Je to proto, že nukleofil útočí ze zadní strany substrátu, čímž přeruší vazbu mezi skupinou opouštějící uhlík a vytvoří vazbu uhlík-nukleofil. Proto, aby byla rychlost reakce SN 2 co nejvyšší, musí být zadní strana substrátu co nejméně omezována. Celkově to znamená, že nejrychleji reagují methylové a primární substráty, následované sekundárními substráty. Terciární substráty se reakcí SN 2 neúčastní kvůli sterickým překážkám.
- Nukleofil. Stejně jako u substrátu ovlivňuje sílu nukleofilu sterická překážka. Například methoxidový aniont je silnou bází i nukleofilem, protože je methylovým nukleofilem, a je tedy velmi málo brzděn. Naproti tomu terc-butoxid je silná báze, ale slabý nukleofil, protože jeho tři methylové skupiny mu brání v přístupu k uhlíku. Síla nukleofilu je také ovlivněna nábojem a elektronegativitou: nukleofilita se zvyšuje s rostoucím záporným nábojem a klesající elektronegativitou. Například OH- je lepší nukleofil než voda a I- je lepší nukleofil než Br- (v polárních protických rozpouštědlech). V polárním aprotickém rozpouštědle se nukleofilita zvyšuje o sloupec periodické tabulky, protože mezi rozpouštědlem a nukleofilem neexistuje vodíková vazba. V tomto případě nukleofilita odráží bazicitu. I- by tedy byl slabším nukleofilem než Br- , protože je slabší zásadou.
- Rozpouštědlo. Rozpouštědlo ovlivňuje rychlost reakce, protože rozpouštědla mohou, ale nemusí obklopovat nukleofil, a tím bránit nebo nebránit jeho přístupu k atomu uhlíku. Polární aprotická rozpouštědla, jako je tetrahydrofuran, jsou pro tuto reakci vhodnějšími rozpouštědly než polární protická rozpouštědla, protože polární protická rozpouštědla budou solvatována vodíkovou vazbou rozpouštědla s nukleofilem. To mu brání v útoku na uhlík s odcházející skupinou.
- Odchod ze skupiny. Leasingová skupina ovlivňuje rychlost reakce. Čím je odcházející skupina stabilnější, tím je pravděpodobnější, že při útoku nukleofilu na uhlík převezme dva elektrony vazby své odcházející skupiny. Čím slabší je tedy ponechávající skupina jako konjugovaná báze, tím lepší je ponechávající skupina. Podobně čím silnější je její odpovídající kyselina, tím lepší je odcházející skupina. Příkladem dobrých levé skupiny jsou halogenidy (kromě fluoridu) a tosylát. HO- a H2 N- však nejsou dobrými opouštějícími skupinami.
Reakční kinetika
Rychlost reakce SN 2 je druhého řádu, protože krok určující rychlost závisí na koncentraci nukleofilu [Nu− ] a také na koncentraci substrátu [RX].
r = k[RX][Nu− ]
To je klíčový rozdíl mezi mechanismy SN 1 a SN 2. V reakci SN 1 nukleofil útočí až po skončení kroku omezujícího rychlost. V reakci SN 2 však nukleofil vytlačuje odstupující skupinu v limitujícím kroku. Jinými slovy, rychlost reakce SN 1 závisí pouze na koncentraci substrátu, zatímco rychlost reakce SN 2 závisí na koncentraci substrátu i nukleofilu. V případech, kdy jsou možné oba mechanismy (například u sekundárního uhlíkového centra), závisí mechanismus na rozpouštědle, teplotě, koncentraci nukleofilu nebo na odcházející skupině.
SN 2 reakce jsou obecně upřednostňovány v primárních alkylhalogenidech nebo sekundárních alkylhalogenidech s aprotickým rozpouštědlem. V terciárních alkylhalogenidech probíhají v zanedbatelné míře v důsledku sterických překážek.
SN 2 a SN 1 jsou dva extrémy klouzavé škály reakcí. Je možné najít mnoho reakcí, které ve svých mechanismech vykazují jak charakter SN 2, tak SN 1. Například je možné získat kontaktní iontové páry vytvořené z alkylhalogenidu, při nichž nejsou ionty zcela odděleny. Při jejich substituci se stereochemie u mnoha reagujících molekul obrátí (jako v případě SN 2), ale několik z nich může vykazovat zachování konfigurace. Reakce SN 2 jsou častější než reakce SN 1.
Soutěž E2
Častou vedlejší reakcí, která probíhá při reakcích SN 2, je eliminace E2: vstupující aniont může působit spíše jako báze než jako nukleofil, čímž se odstraní proton a vznikne alken. Tento efekt lze demonstrovat na reakci v plynné fázi mezi sulfonanem a jednoduchým alkylbromidem, která probíhá uvnitř hmotnostního spektrometru:

V případě ethylbromidu je produktem reakce převážně substituční produkt. S rostoucí sterickou překážkou kolem elektrofilního centra, jako je tomu u isobutylbromidu, je substituce nevýhodná a převažující reakcí je eliminace. Dalšími faktory, které podporují eliminaci, jsou síla báze. S méně bazickým benzoátovým substrátem reaguje isopropylbromid s 55% substitucí. Obecně lze říci, že reakce v plynné fázi a reakce v roztokové fázi tohoto typu sledují stejné trendy, i když v prvním případě odpadá vliv rozpouštědla.
Mechanismus kruhového objezdu
Vývoj, který vzbudil pozornost v roce 2008, se týká koloběhového mechanismu SN 2 pozorovaného v reakci mezi chloridovými ionty a methyljodidem v plynné fázi pomocí speciální techniky nazývané zobrazování zkříženými molekulovými svazky. Pokud mají chloridové ionty dostatečnou rychlost, je energie výsledných jodidových iontů po srážce mnohem nižší, než se očekávalo, a předpokládá se, že energie se ztrácí v důsledku úplného obtočení methylové skupiny kolem jodového atomu dříve, než dojde k vlastnímu přemístění.
Související stránky
- Substituční reakce
- SN 1 reakce
Otázky a odpovědi
Otázka: Co je to reakce SN2?
Odpověď: Reakce SN2 je substituční reakce v organické chemii, při níž nukleofil napadá elektrofilní centrum s nedostatkem elektronů, vytlačuje odcházející skupinu a v jednom kroku ji nahrazuje.
Otázka: Jaký druh substituční reakce je reakce SN2?
Odpověď: Reakce SN2 je typem nukleofilní substituční reakce.
Otázka: Kolik reagujících druhů se účastní pomalého, rychlost určujícího kroku reakce SN2?
Odpověď: Na pomalém, rychlost určujícím kroku reakce SN2 se podílejí dva reakční druhy.
Otázka: Co znamená název "bimolekulární nukleofilní substituce" pro reakci SN2?
Odpověď: Název "bimolekulární nukleofilní substituce" pro reakci SN2 odkazuje na skutečnost, že se na pomalém, rychlost určujícím kroku reakce podílejí dva reagující druhy.
Otázka: Co je nukleofil v kontextu reakce SN2?
Odpověď: Nukleofil je molekula nebo ion, který daruje osamělý pár elektronů za účelem vytvoření chemické vazby.
Otázka: Co je elektrofil v kontextu reakce SN2?
Odpověď: Elektrofil je molekula nebo ion, který přijímá pár elektronů za účelem vytvoření chemické vazby.
Otázka: Jak se reakce SN2 často nazývá mezi anorganickými chemiky?
Odpověď: Mezi anorganickými chemiky je reakce SN2 často známá jako výměnný mechanismus.
Vyhledávání