Karbokacion
Karbokacion je iont s kladně nabitým atomem uhlíku. Nabitý atom uhlíku v karbokationtu je "sextet" (to znamená, že má ve vnější valenční slupce pouze šest elektronů místo osmi valenčních elektronů). Atomy uhlíku s osmi valenčními volty mají maximální stabilitu (pravidlo oktetu). Proto jsou karbokationty často reaktivní a snaží se zaplnit oktet valenčních elektronů a také získat zpět neutrální náboj. Logika by říkala, že karbokacie mají sp3 hybridizaci s prázdným sp 3orbitalem, který dává kladný náboj. Reaktivita karbokationtu se však více podobá sp 2hybridizaci s trigonální planární geometrií molekuly.
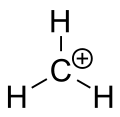
Karbenový ion methanu

terc-butylový kationt, prokazující planární geometrii
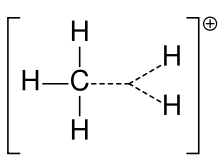
Karboniový ion methanu
Definice
Karbokacion byl dříve často označován jako karboniový iont, ale chemici o přesném významu pochybují. V dnešní chemii je karbocation jakýkoli kladně nabitý atom uhlíku. Byly navrženy dva zvláštní typy: karbeniové ionty jsou trojmocné a karboniové ionty jsou pěti- nebo šestimocné. V učebnicích na univerzitní úrovni se o karbokationtech hovoří pouze jako o karbeniových iontech nebo se o karbokationtech hovoří s letmým odkazem na starší slovní spojení karbeniový ion nebo karbenium a karboniové ionty. Jedna učebnice dodnes zůstává u staršího názvu karbeniový ion pro karbeniový ion a výraz hypervalentní karbeniový ion vyhrazuje pro CH5+.
Historie
V roce 1891 G. Merling oznámil, že přidal brom k tropylidenu (cykloheptatrienu) a poté produkt zahřál, čímž získal krystalickou, ve vodě rozpustnou látku C
7H
7Br. Nenavrhl jeho strukturu, avšak Doering a Knox přesvědčivě prokázali, že se jedná o tropylium (cykloheptatrienylium) bromid. Podle Hückelova pravidla se předpokládá, že tento iont je aromatický.
V roce 1902 Norris a Kehrman nezávisle na sobě zjistili, že bezbarvý trifenylmetanol dává v koncentrované kyselině sírové sytě žluté roztoky. Trifenylmetylchlorid podobně tvořil oranžové komplexy s chloridy hliníku a cínu. V roce 1902 rozpoznal Adolf von Baeyer solný charakter vznikajících sloučenin.

Vztah mezi barvou a tvorbou solí nazval halochromií, jejíž ukázkovým příkladem je malachitová zeleň.
Karbokationty jsou reaktivní meziprodukty v mnoha organických reakcích. Tuto myšlenku, kterou poprvé navrhl Julius Stieglitz v roce 1899, dále rozvinul Hans Meerwein ve své studii Wagner-Meerweinova přeskupení z roku 1922. Bylo také zjištěno, že karbokationty se účastní reakce NS1, reakce E1 a reakcí přeskupení, jako je Whitmorův posun 1,2. Chemický establishment se zdráhal přijmout pojem karbokationt a časopis Journal of the American Chemical Society dlouho odmítal články, které se o nich zmiňovaly.
První NMR spektrum stabilního karbokationu v roztoku publikovali Doering a spol. v roce 1958. Jednalo se o heptamethylbenzenoniový ion, který vznikl působením hexamethylbenzenu s methylchloridem a chloridem hlinitým. Stabilní 7-norbornadienylkationt připravili Story a spol. v roce 1960 reakcí norbornadienylchloridu s tetrafluoroboranem stříbrným v oxidu siřičitém při -80 °C. NMR spektrum prokázalo, že se jedná o neklasicky přemostěný ion (první pozorovaný stabilní neklasický ion).
V roce 1962 Olah přímo pozoroval terc-butylkarbocation pomocí nukleární magnetické rezonance jako stabilní druh při rozpouštění terc-butylfluoridu v kyselině magické. NMR norbornylového kationtu poprvé popsali Schleyer a spol. a Saunders a spol. prokázali, že podléhá protonovému rozkmitání přes bariéru.
Vlastnosti
V organické chemii je karbokation často cílem nukleofilního útoku nukleofilů, jako jsou hydroxylové (OH−) ionty nebo halogenové ionty.
Podle počtu atomů uhlíku vázaných na ionizovaný uhlík se karboxyty dělí na primární, sekundární nebo terciární. Primární karboxyty mají k ionizovanému uhlíku připojen jeden nebo nula uhlíků, sekundární karboxyty mají k ionizovanému uhlíku připojeny dva uhlíky a terciární karboxyty mají k ionizovanému uhlíku připojeny tři uhlíky.
Stabilita karbokacionu se zvyšuje s počtem alkylových skupin vázaných na uhlíku nesoucím náboj. Terciární karbokationty jsou stabilnější (a tvoří se snadněji) než sekundární karbokationty; primární karbokationty jsou vysoce nestabilní, protože zatímco ionizované uhlíky vyššího řádu jsou stabilizovány hyperkonjugací, nesubstituované (primární) uhlíky nikoli. Proto reakce, jako je reakce NS1 a eliminační reakce E1, obvykle neprobíhají, pokud by se vytvořil primární karbokation. Výjimka nastává v případě, že se vedle ionizovaného uhlíku nachází dvojná vazba uhlík-uhlík. Takové kationty, jako je allylový kationt CH=CH-CH22+ a benzylový kationt6 CH-CH52+, jsou stabilnější než většina ostatních karbokationtů. Molekuly, které mohou tvořit allylové nebo benzylové karbokationty, jsou obzvláště reaktivní.
U karbokationtů probíhají reakce přeskupování z méně stabilních struktur na stejně stabilní nebo stabilnější s rychlostními konstantami přesahujícími 10/s9. Tato skutečnost komplikuje syntetické cesty k mnoha sloučeninám. Například při zahřívání 3-pentanolu s vodnou HCl se původně vzniklý 3-pentylkarbocation přeskupí na statistickou směs 3-pentylu a 2-pentylu. Tyto kationty reagují s chloridovým iontem za vzniku přibližně 1/3 3-chlorpentanu a 2/3 2-chlorpentanu.
Některé karbokationty, jako například norbornylový kationt, vykazují více či méně symetrickou třícentrickou vazbu. Kationty tohoto druhu se označují jako neklasické ionty. Energetický rozdíl mezi "klasickými" karbokationty a "neklasickými" izomery je často velmi malý a při přechodu mezi "klasickou" a "neklasickou" strukturou je obecně malá, pokud vůbec nějaká aktivační energie. "Neklasická" forma 2-butylového karbokationu je v podstatě 2-buten s protonem přímo nad středem dvojné vazby uhlík-uhlík. "Neklasické" karbokace byly kdysi předmětem velkých sporů. Jedním z největších přínosů George Olaha pro chemii bylo vyřešení této kontroverze.
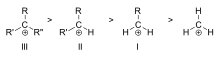
Pořadí stability příkladů terciárních (III), sekundárních (II) a primárních (I) alkylových karbokationtů
Specifické karbokationty
Cyklopropylkarbinylkationty lze studovat pomocí NMR:

V NMR spektru dimethylderivátu jsou nalezeny dva neekvivalentní signály pro dvě methylové skupiny, což naznačuje, že molekulová konformace tohoto kationtu není kolmá (jako v A), ale je rozpolcená (jako v B) s prázdným p-orbitalem a cyklopropylovým kruhovým systémem ve stejné rovině:

Z hlediska teorie ohnutých vazeb se tato preference vysvětluje předpokladem příznivého překryvu orbitalů mezi naplněnými ohnutými vazbami cyklopropanu a prázdným p-orbitalem.
Otázky a odpovědi
Otázka: Co je to karbokation?
Odpověď: Karbokacion je iont s kladně nabitým atomem uhlíku.
Otázka: Jaká je vnější valenční slupka karbokationu?
Odpověď: Vnější valenční slupka karbokationu má pouze šest elektronů místo stabilních osmi valenčních elektronů.
Otázka: Proč jsou karbokationty často reaktivní?
Odpověď: Karbokace jsou často reaktivní, protože se snaží zaplnit oktet valenčních elektronů a také získat zpět neutrální náboj.
Otázka: Jaká je maximální stabilita atomů uhlíku?
Odpověď: Maximální stabilita atomů uhlíku je dosažena, když mají osm valenčních elektronů.
Otázka: Co je v chemii sextet?
Odpověď: Sextet je termín používaný pro označení atomu uhlíku v karbokationtu, který má ve vnější valenční slupce pouze šest elektronů místo stabilních osmi valenčních elektronů.
Otázka: Jaká je hybridizace a molekulová geometrie karbokationtu?
Odpověď: Ačkoli by logika napovídala, že karbokationty mají hybridizaci sp3 s prázdným orbitalem sp3, který dává kladný náboj, jejich reaktivita se více podobá hybridizaci sp2 s trigonální rovinnou molekulovou geometrií.
Otázka: Co je to oktetové pravidlo?
Odpověď: Oktetové pravidlo je princip v chemii, který říká, že atomy mají tendenci vytvářet chemické vazby s jinými atomy, které umožňují, aby oba atomy měly stabilní sadu osmi valenčních elektronů.
Vyhledávání