Elektronový obal
Elektronový obal je vnější část atomu kolem atomového jádra. Je to místo, kde se nacházejí elektrony, a je to skupina atomových orbitalů se stejnou hodnotou hlavního kvantového čísla n.
Elektronové slupky mají jednu nebo více elektronových podslupek neboli podúrovní. Tyto podúrovně mají dva nebo více orbitalů se stejným kvantovým číslem momentu hybnosti l. Elektronové slupky tvoří elektronovou konfiguraci atomu. Počet elektronů, které mohou být v jedné slupce, je roven 2 n 2 {\displaystyle 2n^{2}}. 
Název pro elektronové slupky pochází z Bohrova modelu, v němž se předpokládalo, že skupiny elektronů obíhají kolem jádra v určitých vzdálenostech, takže jejich dráhy tvoří "slupky". Tento termín zavedl dánský lékař Niels Henrik David Bohr.
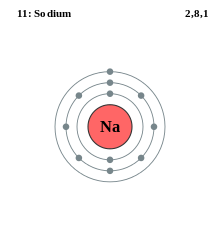
Příklad modelu sodíkového elektronového obalu, který má tři slupky
Valenční obal
Valenční slupka je nejvnější slupka atomu v nespojitém stavu, která obsahuje elektrony, jež s největší pravděpodobností určují povahu všech reakcí, jichž se atom účastní, a vazebných interakcí, které má s ostatními atomy. Je třeba si uvědomit, že nejvzdálenější slupka iontu není běžně označována jako valenční slupka. Elektrony ve valenční slupce se označují jako valenční elektrony.
Ve vzácném plynu má atom ve své vnější slupce obvykle 8 elektronů (s výjimkou helia, které může svou slupku zaplnit pouze 2 elektrony). To slouží jako model pro oktetové pravidlo, které se většinou vztahuje na prvky hlavní skupiny druhé a třetí periody. Z hlediska atomových orbitalů jsou elektrony ve valenční slupce rozloženy po 2 v jediném s orbitalu a po 2 ve třech p orbitalech.
U koordinačních komplexů obsahujících přechodné kovy se valenční slupka skládá z elektronů v těchto s a p orbitalech a až z 10 dalších elektronů, které jsou rozděleny po 2 elektronech do každého z 5 d orbitalů, takže v úplné valenční slupce takové sloučeniny je celkem 18 elektronů. Toto pravidlo se označuje jako pravidlo osmnácti elektronů.
| Možný počet elektronů ve slupkách 1-5 | |
| Shell | Elektrony |
| 1 | 2 |
| 2 | 8 |
| 3 | 18 |
| 4 | 32 |
| 5 | 32 |
| 6 | 18 |
| 7 | 8 |
Podskupiny
Elektronové slupky se označují písmeny s, p, d, f, g, h, i atd., která odpovídají azimutálním kvantovým číslům (l-hodnotám) 0, 1, 2, 3, 4, 5, 6 atd. Každá slupka může obsahovat až 2, 6, 10, 14, resp. 18 elektronů, neboli 2(2l + 1) elektronů v každé podslupce. Zápis "s", "p", "d" a "f" pochází z dnes již zdiskreditovaného systému kategorizace spektrálních čar na "ostré", "hlavní", "rozptýlené" nebo "základní" na základě jejich pozorované jemné struktury. Když byly popsány první čtyři typy orbitalů, byly spojeny s těmito typy spektrálních čar, ale neexistovaly žádné další názvy. Označení "g", "h" atd. byla odvozena podle abecedního pořadí.
Otázky a odpovědi
Otázka: Co je to elektronový obal?
Odpověď: Elektronový obal neboli hlavní energetická hladina je část atomu, kde se nacházejí elektrony obíhající kolem jádra atomu.
Otázka: Kolik elektronů může být v určitém obalu?
Odpověď: Počet elektronů, které mohou být v určitém obalu, je roven 2n2.
Otázka: Co uvádí Bohrův model o elektronech?
Odpověď: Bohrův model říká, že elektrony obíhají kolem jádra v určitých vzdálenostech, takže jejich dráhy tvoří "slupky".
Otázka: Kdo zavedl tento termín?
Odpověď: Tento termín zavedl Niels Henrik David Bohr.
Otázka: Co tvoří elektronovou konfiguraci atomu?
Odpověď: Elektronové slupky tvoří elektronovou konfiguraci atomu.
Otázka: Skládají se všechny atomy z jednoho nebo více elektronových obalů?
Odpověď: Ano, všechny atomy mají jeden nebo více elektronových obalů.
Otázka: Mají všechny elektronové obaly různý počet elektronů?
Odpověď: Ano, všechny elektronové obaly mají různý počet elektronů.
Vyhledávání