Kovalentní vazba
Kovalentní vazby jsou chemické vazby mezi dvěma nekovovými atomy. Příkladem je voda, kde vodík (H) a kyslík (O) tvoří vazbu (H2O). Plná vnější slupka má obvykle osm elektronů, v případě vodíku nebo helia dva. Valenční elektrony jsou elektrony držené poměrně volně ve vnějším obalu atomu. Strukturu elektronových slupek určuje kvantová mechanika).
O počtu elektronů v atomu rozhoduje počet protonů v atomu. Elektrony obíhají kolem atomových jader a jsou jako rozmazané orbitální dráhy kolem atomového jádra. První vrstva má až dva elektrony. Následující vrstvy jich obvykle obsahují až osm. Kovalentní vazby vznikají tak, že atomy sdílejí valenční elektrony.
Pokud má například atom devět elektronů, první dva obíhají velmi blízko jádra, dalších sedm obíhá o něco dále. Vnějších sedm elektronů je méně pevně drženo než vnitřní dva elektrony, protože jsou dále od kladně nabitého jádra. Pokud se tento atom přiblíží k jinému atomu s volně drženým elektronem ve vnějším obalu, uvolní se pro volně držený elektron nový orbital. Tento nový elektronový orbital je vázán na obě atomová jádra a má nižší energetickou hladinu než původní elektronový orbital. Elektron na něj může samovolně přeskočit a vyzářit foton s přebytečnou energií. Nyní máme elektron obíhající kolem obou atomů, což má za následek, že atom, který elektron poskytl, má malý čistý kladný náboj a druhý atom má malý čistý záporný náboj. Oba atomy jsou nyní drženy pohromadě elektromagnetickou přitažlivou silou mezi kladným a záporným nábojem. Tomu se říká kovalentní vazba. K přerušení této vazby je třeba stejné množství energie, jaké se uvolnilo při jejím vzniku.
Molekula vody se skládá z jednoho atomu kyslíku a dvou atomů vodíku, které jsou spojeny kovalentní vazbou. V tomto případě sdílí atom kyslíku s každým atomem vodíku jeden elektron. To znamená, že atomy kyslíku mají malý čistý kladný náboj a atomy vodíku mají malý čistý záporný náboj. V důsledku toho se atomy kyslíku a vodíku vzájemně přitahují vlivem elektromagnetické síly. Z tohoto důvodu je molekula vody polární molekulou: její náboj není rovnoměrně rozložen.
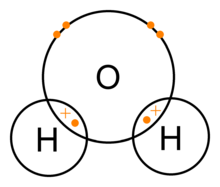
Kovalentní vazby vody (H2O)
Typy kovalentních vazeb
Atomové orbitaly (s výjimkou orbitalů s) vytvářejí různé typy kovalentních vazeb:
- Sigma (σ) vazby jsou nejpevnější kovalentní vazby. Dochází v nich k překrývání orbitalů na dvou různých atomech. Jediná vazba je obvykle vazbou σ.
- Vazby pí (π) jsou slabší a jsou způsobeny bočním překrytím orbitalů p (nebo d).
- Dvojná vazba mezi dvěma danými atomy má jednu σ a jednu π vazbu a
- trojná vazba má jednu σ a dvě π vazby.
Kovalentní vazby jsou slabší než iontové a mají nižší teplotu tání. Jsou také obecně špatnými vodiči elektřiny a tepla.
Délka vazby
V chemii je délka vazby mírou velikosti kovalentní vazby. Protože jsou molekuly velmi malé, měří se v pikometrech, což je přibližně jedna miliontina miliardtiny metru.
Chemie molekul je vysvětlována především jejich vazbami, přičemž vazby jsou způsobeny jejich elektronovou strukturou.
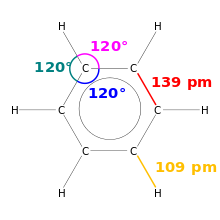
Kresba benzenu. Jsou znázorněny délky vazeb a vazebné úhly.
Související stránky
- Valence
Otázky a odpovědi
Otázka: Co je to kovalentní vazba?
Odpověď: Kovalentní vazba je chemická vazba mezi dvěma nekovovými atomy, kde atomy sdílejí valenční elektrony. Vzniká tak elektronový orbital, který je vázán na obě atomová jádra a má nižší energetickou hladinu než původní elektronový orbital. V důsledku toho má atom, který poskytl elektron, malý čistý kladný náboj a druhý atom má malý čistý záporný náboj, které jsou drženy pohromadě elektromagnetickou přitažlivou silou mezi kladnými a zápornými náboji.
Otázka: Kolik elektronů má obvykle atom ve svém vnějším obalu?
Odpověď: Vnější obal atomu obvykle obsahuje až osm elektronů nebo dva elektrony v případě vodíku nebo helia.
Otázka: Co určuje počet elektronů v atomu?
Odpověď: Počet elektronů v atomu je určen počtem protonů v atomu.
Otázka: Jak vznikají kovalentní vazby?
Odpověď: Kovalentní vazby vznikají, když se atomy přiblíží k sobě a jeden volně držený elektron z jednoho atomu přeskočí do nového orbitalu, který je vázán na obě atomová jádra s nižší energetickou hladinou než předtím. To má za následek, že jeden atom má malý čistý kladný náboj a druhý malý čistý záporný náboj, čímž mezi nimi vzniká elektromagnetická přitažlivá síla.
Otázka: Jaký typ molekuly je voda?
Odpověď: Molekuly vody se skládají z jednoho atomu kyslíku a dvou atomů vodíku, které drží pohromadě kovalentní vazbou, což z ní činí polární molekulu, protože její náboj není rovnoměrně rozložen.
Otázka: Kde obíhají elektrony kolem atomových jader?
Odpověď: Elektrony obíhají kolem atomových jader jako rozmazané orbitální dráhy.
Vyhledávání