Kyseliny
Článek o některých vlastnostech databází je na adrese ACID
Někdy je acid jiný název pro drogu LSD (diethylamid kyseliny lysergové).
Kyselina je látka, která může darovat vodíkový ion (H+ ) (obecně řečeno proton) jiné látce. Kyseliny mají pH nižší než 7,0. Chemická látka může darovat proton, pokud je atom vodíku připojen k elektronegativnímu atomu, jako je kyslík, dusík nebo chlor. Některé kyseliny jsou silné a jiné slabé. Slabé kyseliny si drží některé své protony, zatímco silné kyseliny je všechny uvolňují. Všechny kyseliny uvolňují do roztoků vodíkové ionty. Množství uvolněných iontů na molekulu určuje, zda je kyselina slabá nebo silná. Slabé kyseliny jsou kyseliny, které částečně uvolňují navázané atomy vodíku. Tyto kyseliny tedy mohou snižovat pH disociací vodíkových iontů, ale ne zcela. Slabé kyseliny mají obvykle hodnotu pH 4-6, zatímco silné kyseliny mají hodnotu pH 1 až 3.
Zásada je "chemickým opakem kyseliny". Zásada je látka, která přijme atom vodíku kyseliny. Zásady jsou molekuly, které se mohou ve vodě štěpit a uvolňovat hydroxidové ionty.

Kyselina chlorovodíková (v kádince) reaguje s výpary amoniaku za vzniku chloridu amonného (bílý kouř).
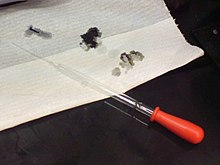
Kyseliny mohou být nebezpečné: Díry v papíru byly vytvořeny roztokem 98% kyseliny sírové.
Jak fungují kyseliny
Kyseliny a zásady obvykle existují společně v rovnováze. To znamená, že ve vzorku kyseliny některé molekuly odevzdávají své protony a jiné je přijímají. I voda je směsí kyselého iontu H3 O+ (tzv. hydroniového iontu) a bazického iontu OH- (tzv. hydroxidového iontu). Hydroniový iont odevzdá svůj proton hydroxidovému iontu a vytvoří dvě molekuly H2 O, který je neutrální. Tato reakce probíhá ve vzorku vody nepřetržitě, ale celkově je vzorek neutrální, protože ve vzorku je stejné množství hydronia a hydroxidu. U většiny reakcí však kyseliny a zásady nejsou přítomny ve stejném množství a právě tato nerovnováha umožňuje průběh chemické reakce.
Každá kyselina má konjugovanou zásadu, která vzniká odebráním protonu kyseliny. Například kyselina chlorovodíková (HCl) je kyselina a její konjugovanou bází je aniont chloru neboli Cl-. Kyselina a její konjugovaná zásada mají opačnou sílu. Protože HCl je silná kyselina, Cl -je slabá zásada.
Vlastnosti
Kyseliny mohou mít různou sílu, některé jsou reaktivnější než jiné. Reaktivnější kyseliny jsou často nebezpečnější.
Kyseliny mohou mít mnoho různých vlastností v závislosti na své molekulární struktuře. Většina kyselin má následující vlastnosti:
- při konzumaci chutnají kysele
- mohou při dotyku štípat do kůže
- může způsobit korozi (nebo poškození) kovů a kůže.
- lze použít jako reaktant při elektrolýze díky přítomnosti mobilních iontů.
- změní modrý lakmusový papírek na červený
- na univerzálním indikátoru se rozsvítí červená nebo oranžová barva
- vést elektřinu
Kyseliny mohou pokožku popálit, přičemž závažnost popálení závisí na typu a koncentraci kyseliny. Tyto chemické popáleniny vyžadují okamžitou lékařskou pomoc.
Protože kyseliny darují vodíkové ionty, všechny kyseliny musí obsahovat vodík.

Výstražný obrázek používaný s nebezpečnými kyselinami a nebezpečnými zásadami. Zásady jsou opakem kyselin.
Důležitost
Kyseliny jsou důležité. Nukleové kyseliny, jako je DNA a RNA, obsahují genetický kód. Tyto molekuly určují mnoho vlastností organismu, přenášejí se z rodičů na potomky. DNA obsahuje plány, jak postavit bílkoviny, které se skládají z aminokyselin.
Další skupinou karboxylových kyselin, které hrají významnou roli v biologii, jsou mastné kyseliny a jejich deriváty. Obsahují dlouhé řetězce uhlovodíků a na jednom konci skupinu karboxylové kyseliny. Buněčná membrána téměř všech organismů je tvořena především fosfolipidovou dvojvrstvou, micelou hydrofobních řetězců mastných kyselin s polárními, hydrofilními fosfátovými "hlavovými" skupinami.
U lidí a mnoha dalších živočichů je kyselina chlorovodíková součástí žaludeční kyseliny vylučované v žaludku. Pomáhá hydrolyzovat bílkoviny a polysacharidy. Může také přeměnit neaktivní proenzym pepsinogen na enzym pepsin. Některé organismy produkují kyseliny na obranu; například mravenci produkují kyselinu mravenčí a octomilky produkují černou kyselinu zvanou magneta.
Většinu kyselin lze nalézt v přírodě. Mezi ně patří například tyto:
- Ocet je pravděpodobně jedním z nejznámějších; obsahuje kyselinu octovou, která mu dodává známou chuť.
- Kyselina dusičná, NHO, je známá 3přibližně od 13. století.
- Kyselinycitronové, C6 H8 O7, se nacházejí v mnoha druzích ovoce. Objevil je pravděpodobně Geber v 8. století.
- Kyselinu mléčnou, C3 H6 O3, objevil Carl Wilhelm Scheele v roce 1780. Najdeme ji v zakysaných mléčných výrobcích, jako je jogurt.
- Kyselinu sírovou, H2 SO4, objevil pravděpodobně Geber. Dnes ji lze nalézt v bateriích.
Související stránky
- Alkálie
- Kyselina listová
Otázky a odpovědi
Otázka: Co je to KYSELINA?
Odpověď: ACID je článek o určitých vlastnostech databází.
Otázka: Co je to kyselina obecně?
Odpověď: Kyselina obecně je látka, která může darovat vodíkový iont (H+) jiné látce, s pH nižším než 7,0. Kyselina je látka, která může darovat vodíkový iont (H+) jiné látce.
Otázka: Za jakých podmínek může chemická látka darovat proton?
Odpověď: Chemická látka může darovat proton, pokud je atom vodíku připojen k elektronegativnímu atomu, jako je kyslík, dusík nebo chlor.
Otázka: Jaký je rozdíl mezi silnými a slabými kyselinami?
Odpověď: Silné kyseliny uvolňují všechny své protony, zatímco slabé kyseliny si některé z nich drží. Množství uvolněných iontů na molekulu určuje, zda je kyselina slabá nebo silná.
Otázka: Jaký je rozsah pH slabých a silných kyselin?
Odpověď: Slabé kyseliny mají obvykle hodnotu pH 4 až 6, zatímco silné kyseliny mají hodnotu pH 1 až 3.
Otázka: Co je to zásada?
Odpověď: Zásada je "chemický opak" kyseliny. Zásada je látka, která přijme atom vodíku kyseliny. Zásady jsou molekuly, které se mohou ve vodě štěpit a uvolňovat hydroxidové ionty.
Otázka: Co je LSD?
Odpověď: LSD (diethylamid kyseliny lysergové) je droga, která se někdy označuje jako kyselina, ale s kyselinou zmíněnou v tomto článku nesouvisí.
Vyhledávání