Cheletropní reakce
Cheletropické reakce jsou typem pericyklické reakce, při níž jeden atom na jednom z činidel získá dvě nové vazby. Pericyklická reakce je reakce, která zahrnuje přechodný stav s cyklickým uspořádáním atomů a souvisejícím cyklickým uspořádáním interagujících orbitalů. V tomto cyklickém poli dochází k reorganizaci vazeb σ a π.
Cheletropické reakce jsou podtřídou cykloadicí. Cheletropické reakce se liší tím, že na jednom z činidel se obě nové vazby vytvářejí na stejný atom. Několik příkladů je uvedeno vpravo na obrázku 1. V prvním případě je jediným atomem atom uhlíku v karbonylové skupině. Tento atom uhlíku končí v oxidu uhelnatém. Konečným výsledkem je vytvoření dvou nových vazeb na jeden atom. První dva příklady jsou známé jako "cheletropické vytlačování", protože při reakci vzniká malá stabilní molekula. Hnací silou těchto reakcí je často entropický přínos uvolnění plynu (např. CO nebo N2).

Obrázek 1. Pericyklické reakce
Teoretická analýza
Vzhledem ke geometrii molekul zapojených do cheletropických reakcí potvrzují řadu předpovědí teoretických chemiků. Cheletropické reakce potvrzují zachování symetrie molekulových orbitalů.
V pericyklickém přechodném stavu malá molekula daruje kruhu dva elektrony. Reakci lze vysvětlit dvěma možnými geometriemi. Malá molekula se může přiblížit buď lineárně, nebo nelineárně. Při lineárním přiblížení směřují elektrony v orbitalu malé molekuly přímo na π systém velké molekuly. Při nelineárním přiblížení se orbital přibližuje pod mírně vychýleným úhlem. Schopnost π-systému rotovat při přibližování malé molekuly je rozhodující pro vytváření nových vazeb. Směr rotace se liší podle toho, kolik π-elektronů je v systému. Schéma dvouelektronového fragmentu přibližujícího se ke čtyřelektronovému π-systému pomocí hraničních molekulových orbitalů je uvedeno níže. Rotace bude disrotační, pokud se malá molekula přibližuje lineárně, a konrotační, pokud se molekula přibližuje nelineárně. Disrotační a konrotační udávají, jakým způsobem rotují vazby v π-systému. Disrotační znamená opačný směr, zatímco konrotační znamená stejný směr. To je také znázorněno v následujícím diagramu.
Pomocí Huckelova pravidla lze určit, zda je π-systém aromatický nebo antiaromatický. Pokud je aromatický, lineární přístupy používají disrotační pohyb, zatímco nelineární přístupy používají konrotační pohyb. Opačný postup platí pro antiaromatický systém. Lineární přístupy budou používat konrotativní pohyb, zatímco nelineární přístupy budou používat disrotativní pohyb.
Cheletropické reakce zahrnující SO2
Termodynamika
Při reakci oxidu siřičitého s butadienem a izoprenem vznikají dva různé produkty. Mechanismus reakce určuje, co vznikne. Je možný jak kinetický, tak termodynamický produkt. Termodynamického produktu vzniká více než kinetického produktu. Kinetický produkt vzniká při Dielsově-Alderově reakci, zatímco při cheletropické reakci vzniká termodynamicky stabilnější produkt. Cheletropická cesta se používá více, protože při ní vzniká stabilnější adukt s pětičlenným kruhem. Níže uvedené schéma ukazuje rozdíl mezi oběma produkty. Cesta vlevo ukazuje termodynamický produkt, zatímco cesta vpravo ukazuje kinetický produkt. Suarez a Sordo to ukázali v roce 1995. Ukázali to jak pomocí experimentů, tak pomocí Gaussových výpočtů.
Kinetika
Příkladem jsou cheletropické reakce 1,3-dienů s oxidem siřičitým. Chemici pečlivě zkoumali kinetiku této reakce. V roce 1976 Isaacs a Laila změřili kenetické faktory pro adici oxidu siřičitého na deriváty butadienu. Rychlost adice sledovali v benzenu při 30 °C s počátečním dvacetinásobným přebytkem dienu. Ke studiu světla při vlnové délce 320 nm použili spektrofotometr, kterým měřili zánik SO2. Reakce vykazovala "pseudokinetiku prvního řádu". Chemici zjistili, že elektron-odtahující skupiny na dienu snižují rychlost reakce. Rychlost reakce byla také značně ovlivněna sterickými účinky 2-substituentů, přičemž objemnější skupiny zvyšovaly rychlost reakce. (Jinými slovy, čím větší byla skupina atomů visících z druhého atomu uhlíku, tím rychleji reakce probíhala.) Autoři to přičítají tendenci objemných skupin zvýhodňovat cisoidní konformaci dienu, která je pro reakci nezbytná (viz tabulka níže). Kromě toho byly pro sedm dienů změřeny rychlosti při čtyřech teplotách. Z těchto měření chemici pomocí Arrheniovy rovnice vypočítali aktivační entalpii (ΔH‡) a aktivační entropii (ΔS‡) pro každou reakci. Jednalo se o jeden z prvních významných pokusů o studium kenetiky cheletropické reakce.
| -Butadien | 104 k /min−1 (30 °C) (± 1-2 %) absolutně | 104 k /min−1 (30 °C) (± 1-2 %) relativní | ΔH ‡/kcal mol−1 | ΔS ‡/cal mol−1 K −1 |
| 2-methyl | 1.83 | 1.00 | 14.9 | -15 |
| 2-ethyl | 4.76 | 2.60 | 10.6 | -20 |
| 2-isopropyl | 13.0 | 7.38 | 12.5 | -17 |
| 2-terc-butyl | 38.2 | 20.8 | 10.0 | -19 |
| 2-neopentyl | 17.2 | 9.4 | 11.6 | -18 |
| 2-cloro | 0.24 | 0.13 | NEUPLATŇUJE SE | NEUPLATŇUJE SE |
| 2-bromoethyl | 0.72 | 0.39 | NEUPLATŇUJE SE | NEUPLATŇUJE SE |
| 2-p-tolyl | 24.7 | 13.5 | 10.4 | -19 |
| 2-fenyl | 17.3 | 9.45 | NEUPLATŇUJE SE | NEUPLATŇUJE SE |
| 2-(p-bromfenyl) | 9.07 | 4.96 | NEUPLATŇUJE SE | NEUPLATŇUJE SE |
| 2,3-dimethyl | 3.54 | 1.93 | 12.3 | -18 |
| cis-1-methyl | 0.18 | 0.10 | NEUPLATŇUJE SE | NEUPLATŇUJE SE |
| trans-1-methyl | 0.69 | 0.38 | NEUPLATŇUJE SE | NEUPLATŇUJE SE |
| 1,2-dimethylen-cyklohexan | 24.7 | 13.5 | 11.4 | -16 |
| 2-methyl-1,1,4,4-d4 | 1.96 | NEUPLATŇUJE SE | NEUPLATŇUJE SE | NEUPLATŇUJE SE |
Monnat, Vogel a Sordo v roce 2002 měřili kinetiku adice oxidu siřičitého na 1,2-dimethylidenecykloalkany. Napsali, že reakcí 1,2-dimethylidenecyklohexanu s oxidem siřičitým mohou vznikat dva různé produkty v závislosti na reakčních podmínkách. Při kinetické kontrole (≤ -60 °C) vzniká odpovídající sultin hetero-Diels-Alderovou reakcí, ale při termodynamické kontrole (≥ -40 °C) vzniká odpovídající sulfolen cheletropickou reakcí. Aktivační entalpie pro hetero-Diels-Alderovu reakci je přibližně o 2 kcal/mol nižší než pro odpovídající cheletropickou reakci. Sulfolen je asi o 10 kcal/mol stabilnější než izometrický sultin v roztoku CHCl/SO. 222
Autorům se podařilo experimentálně stanovit rychlostní zákon při teplotě 261,2 K pro reakci 1,2-dimethylidenecyklohexanu s oxidem siřičitým za vzniku příslušného sulfolenu. Reakce probíhala v prvním řádu pro 1,2-dimethylidenecyklohexan, ale v druhém řádu pro oxid siřičitý (viz níže). To potvrdilo předpověď teoretických chemiků založenou na kvantových výpočtech na vysoké úrovni ab initio. Pomocí výpočetních metod navrhli autoři přechodovou strukturu pro cheletropickou reakci 1,2-dimethylidenecyklohexanu s oxidem siřičitým (viz obrázek vpravo). Reakce je druhého řádu v oxidu siřičitém, protože na přechodový stav se pravděpodobně váže další molekula oxidu siřičitého, která jej pomáhá stabilizovat. Podobné výsledky byly zjištěny ve studii Suareze, Sorda a Sorda z roku 1995, kteří pomocí ab initio výpočtů studovali kinetickou a termodynamickou kontrolu reakce oxidu siřičitého s 1,3-dieny.
d [ ] 3d t = k [ 2]1 [ S O ] 2{\displaystyle2 {\frac {d[3]}{dt}}=k_{2}[1][SO_{2}]^{2}}}
Účinky rozpouštědel
Vliv rozpouštědla na cheletropickou reakci 3,4-dimethyl-2,5-dihydrothiofen-1,1-dioxidu (na obrázku vpravo) byl kineticky zkoumán ve 14 rozpouštědlech. Bylo zjištěno, že rychlostní konstanty reakce vpřed a vzad kromě rovnovážných konstant lineárně korelují se stupnicí polarity rozpouštědla ET(30).
Reakce probíhaly při 120 °C a byly studovány pomocí 1H-NMR spektroskopie reakční směsi. Bylo zjištěno, že dopředná rychlost k1 se snižuje 4,5krát při přechodu z cyklohexanu na methanol. Bylo zjištěno, že reverzní rychlost k-1 se při přechodu z cyklohexanu na methanol zvyšuje 53krát, zatímco rovnovážná konstanta Keq se snižuje 140krát. Předpokládá se, že během aktivačního procesu dochází ke změně polarity, což dokazují vztahy mezi rovnovážnými a kinetickými údaji. Autoři uvádějí, že reakce je zřejmě ovlivněna polaritou rozpouštědla, což lze prokázat změnou dipólových momentů při přechodu od reaktantu k přechodnému stavu a produktu. Autoři rovněž uvádějí, že se nezdá, že by cheletropická reakce byla ovlivněna kyselostí nebo zásaditostí rozpouštědla.
Na základě výsledků této studie autoři očekávají následující chování:
1. Změna polarity rozpouštědla ovlivní rychlost méně než rovnováha.
2. Rychlostní konstanty se budou vyznačovat opačným vlivem na polaritu: k1 se bude mírně snižovat s nárůstem ET(30) a k-1 se bude za stejných podmínek zvyšovat.
3. Vliv na k-1 bude větší než na k1.

Reakce 1,2-dimethylidenecyklohexanu s SO2 za vzniku sulfinu heterodiels-alderovou reakcí pod kinetickou kontrolou nebo sulfolenu cheletropickou reakcí pod termodynamickou kontrolou

Návrh přechodového stavu pro reakci 1,2-dimethylidenecyklohexanu s SO2 za vzniku sulfolenu prostřednictvím cheletropické reakce
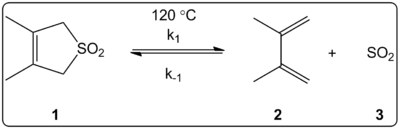
Cheletropická reakce studovaná v různých rozpouštědlech
Adice karbenu na alkeny
Jednou ze synteticky nejdůležitějších cheletropických reakcí je adice singletového karbenu na alken za vzniku cyklopropanu (viz obrázek vlevo). Karben je neutrální molekula obsahující dvojmocný uhlík se šesti elektrony ve valenční slupce. Z tohoto důvodu jsou karbeny vysoce reaktivní elektrofily a vznikají jako meziprodukty reakcí. Singletní karben obsahuje prázdný p orbital a zhruba sp 2hybridní orbital, který má dva elektrony. Singletové karbeny se stereospecificky přidávají k alkenům a stereochemie alkenů je zachována v produktu cyklopropanu. Mechanismus adice karbenu na alken je sladěná [2+1] cykloadice (viz obrázek). Karbeny odvozené z chloroformu nebo bromoformu lze použít k přidání CX2 k alkenu za vzniku dihalocyklopropanu, zatímco Simmons-Smithovo činidlo přidává CH2.
Interakce zaplněného karbenového orbitalu s alkenovým π systémem vytváří čtyřelektronový systém a podporuje nelineární přístup. Příznivé je také smíchání prázdného p orbitalu karbenu s vyplněným π orbitalem alkenu. K příznivému míchání dochází prostřednictvím nelineárního přístupu (viz obrázek 2 vpravo). Zatímco teorie jasně upřednostňuje nelineární přístup, neexistují žádné zřejmé experimentální důsledky pro lineární a nelineární přístup.

Adice karbenu na alken za vzniku cyklopropanu

Obrázek 2. A) Orbitaly pro singletové karbeny B) Nelineární přístup a) sp2 orbitalu karbenu a b) p orbitalu karbenu
Otázky a odpovědi
Otázka: Co je to cheletropická reakce?
Odpověď: Cheletropická reakce je typ pericyklické reakce, při níž jeden atom na jednom z činidel získá dvě nové vazby.
Otázka: Co je to pericyklická reakce?
Odpověď: Pericyklická reakce je reakce, která zahrnuje přechodný stav s cyklickým uspořádáním atomů a souvisejícím cyklickým uspořádáním interagujících orbitalů, při níž dochází k reorganizaci vazeb َ a ً.
Otázka: Jak se liší od jiných typů reakcí?
Odpověď: Cheletropické reakce jsou podtřídou cykloadicí a od ostatních typů reakcí se liší tím, že na jednom z činidel se obě nové vazby vytvářejí na stejný atom.
Otázka: Jaké jsou příklady?
Odpověď: Mezi příklady patří "cheletropické vytěsňování", například když jediný atom v karbonylové skupině skončí v oxidu uhelnatém.
Otázka: Co je hnací silou těchto reakcí?
Odpověď: Hnací silou těchto reakcí je často entropický přínos uvolňování plynu (např. CO nebo N2).
Otázka: Souvisí obrázek 1 s cheletropickými reakcemi? Odpověď: Ano, obrázek 1 ukazuje příklady cheletropických reakcí.
Vyhledávání
![{\displaystyle {\frac {d[3]}{dt}}=k_{2}[1][SO_{2}]^{2}}](https://www.alegsaonline.com/image/a02f69dd0783356fbf24499f57d0df29cd264f16.svg)