Atomová teorie
V chemii a fyzice vysvětluje atomová teorie, jak se v průběhu času měnilo naše chápání atomu. Kdysi byly atomy považovány za nejmenší části hmoty. Nyní je však známo, že atomy se skládají z protonů, neutronů a elektronů. Tyto subatomární částice se skládají z kvarků. S první myšlenkou atomu přišel řecký filozof Démokritos. Mnoho myšlenek moderní teorie pochází od Johna Daltona, britského chemika a fyzika.
Teorie platí pro pevné látky, kapaliny a plyny, ale neplatí obdobně pro plazma nebo neutronové hvězdy.

Démokritos byl řecký filozof, 460 př. n. l.

Roger Joseph Boscovich. Chorvatský jezuita, který vytvořil prototyp atomové teorie.

John Dalton (1766-1844), anglický chemik a fyzik
Sir Joseph John Thomson (1856-1940), anglický fyzik, objevil elektron a jeho záporný náboj. Dostal Nobelovu cenu za fyziku.
Démokritova atomová teorie
Démokritos si myslel, že když něco stále znovu a znovu rozkrajujete, nakonec musíte přestat. Říkal, že tento poslední kousek hmoty už nelze rozříznout na menší. Démokritos tyto malé kousky hmoty nazýval atomy, což znamená "nedělitelné". Domníval se, že atomy vydrží věčně, nikdy se nezmění a nelze je zničit. Démokritos se domníval, že mezi atomy nic není a že vše kolem nás lze vysvětlit, pokud pochopíme, jak atomy fungují.
Někteří další filozofové s ním souhlasili, jiní ne. Neměli možnost experimentálně prokázat, zda je jeho teorie pravdivá, nebo ne.
Boscovichova atomová teorie
V roce 1758 popsal Roger Joseph Boscovich předchůdce atomové teorie.
Daltonova atomová teorie
V roce 1803 anglický vědec John Dalton, rodák z Cumberlandu, přepracoval Démokritovu teorii takto:
- Veškerá hmota je tvořena atomy.
- Že atomy jsou nedělitelné a neviditelné částice.
- Že atomy stejného prvku jsou stejného typu a hmotnosti.
- Atomy, které tvoří chemické sloučeniny, jsou zastoupeny ve stanovených poměrech.
- Chemické změny odpovídají reorganizaci atomů, které se účastní chemické reakce.
Dalton definoval atom jako základní jednotku prvku, která se může účastnit chemické kombinace.
Thomsonův atomový model
V roce 1850 sestrojil sir William Crookes "výbojku", tj. skleněnou trubici s odstraněným vzduchem a kovovými elektrodami na koncích, připojenou ke zdroji vysokého napětí. Při vytvoření vakua v trubici lze pozorovat světelný výboj, který jde od katody (záporně nabité elektrody) k anodě (kladně nabité elektrodě). Crookes tuto emisi nazval "katodové paprsky".
Po pokusech s katodovými paprsky sir Joseph John Thomson zjistil, že vyzařovaný paprsek je tvořen zápornými náboji, protože jsou přitahovány kladným pólem. Thomson věděl, že atomy jsou elektricky neutrální, ale zjistil, že aby k tomu došlo, měl by mít atom stejné množství záporných a kladných nábojů. Záporné náboje byly pojmenovány elektrony (e-).
Na základě předpokladů o neutrálním náboji atomů navrhl Thomson první model atomu, který byl popsán jako kladně nabitá koule, v níž byly vloženy elektrony (se záporným nábojem). Je známý jako model švestkového pudinku.
V roce 1906 Robert Millikan určil, že elektrony mají Coulombův (C) náboj -1,6 * 10−19, což umožnilo vypočítat jejich hmotnost jako nepatrnou, rovnající se 9,109 * 10 −31kg.
V téže době Eugene Goldstein v roce 1886 při pokusech s katodovými výbojkami zjistil, že kladné náboje mají hmotnost 1,6726 * 10 −27kg a elektrický náboj +1,6 * 10 C−19. Lord Ernest Rutherford později tyto kladně nabité částice pojmenoval protony.

Schematické znázornění Thomsonova modelu.
Rutherfordův atomový model
V roce 1910 přišel novozélandský fyzik Ernest Rutherford s myšlenkou, že kladné náboje atomu se nacházejí především v jeho středu, v jádře, a elektrony (e-) kolem něj.
Rutherford to dokázal, když použil zdroj záření alfa (z helia) k zasažení velmi tenkých plátků zlata obklopených stínítkem ze sulfidu zinečnatého, které při zásahu zářením alfa vydávalo viditelné světlo. Tento pokus se nazýval Geiger-Marsdenův experiment nebo experiment se zlatou fólií.
V této fázi již byly jasné hlavní prvky atomu a objev, že atomy prvku se mohou vyskytovat v izotopech. Izotopy se liší počtem neutronů přítomných v jádře. Ačkoli byl tento model dobře pochopen, moderní fyzika se vyvíjela dále a současné představy nelze snadno pochopit. Určitou představu o současné atomové fyzice najdete v odkazech v tabulce níže.
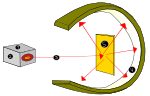
Atomový experiment lorda Ernesta Rutherforda
Moderní fyzika
Atomy nejsou elementární částice, protože se skládají ze subatomárních částic, jako jsou protony a neutrony. Protony a neutrony také nejsou elementárními částicemi, protože se skládají z ještě menších částic zvaných kvarky, které jsou spojeny dalšími částicemi zvanými gluony (protože "slepují" kvarky dohromady v atomu). Kvarky jsou elementární, protože je nelze dále rozložit.
Otázky a odpovědi
Otázka: Co je to atomová teorie?
Odpověď: Atomová teorie vysvětluje, jak se v průběhu času měnilo naše chápání atomu.
Otázka: Co se kdysi považovalo za atomy?
Odpověď: Kdysi byly atomy považovány za nejmenší části hmoty.
Otázka: Z čeho se vlastně atomy skládají?
Odpověď: Atomy se skládají z protonů, neutronů a elektronů.
Otázka: Z čeho se skládají subatomární částice?
Odpověď: Subatomární částice se skládají z kvarků.
Otázka: Kdo je řecký filozof, který jako první přišel s myšlenkou atomu?
Odpověď: S první myšlenkou atomu přišel řecký filozof Démokritos.
Otázka: Kdo je britský chemik a fyzik, který přispěl mnoha myšlenkami k moderní teorii?
Odpověď: John Dalton, britský chemik a fyzik, který přispěl mnoha myšlenkami k moderní teorii.
Otázka: Vztahuje se atomová teorie na plazma nebo neutronové hvězdy?
Odpověď: Teorie platí pro pevné látky, kapaliny a plyny, ale neplatí analogicky pro plazma nebo neutronové hvězdy.
Vyhledávání