Molekulární vibrace
Molekulární vibrace jsou jedním ze tří různých druhů pohybu molekul, které zahrnují translační pohyb (kdy se celá molekula pohybuje stejným směrem) a rotační pohyb (kdy se molekula otáčí jako vrchol).
Vibrační pohyb molekuly je pohyb vazeb mezi atomy v molekule. Představte si atomy jako kulaté kuličky spojené pružinou, která se může natahovat dopředu a dozadu. Příkladem tohoto pohybu je "protahování", které je nejjednodušším příkladem vibrací pro molekulu a probíhá pouze mezi dvěma atomy. Mezi příklady molekul, které se takto chovají, patří vodík H2 , dusík N2 a kyslík O2 .
Typy vibrací
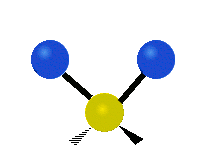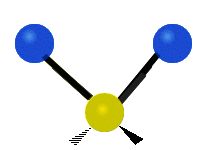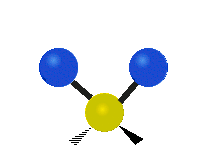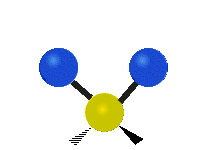
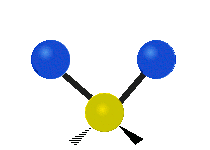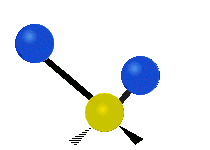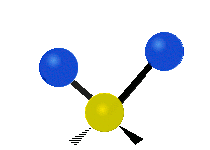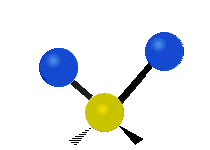
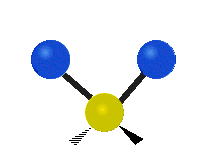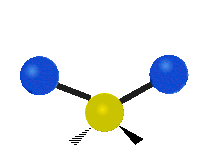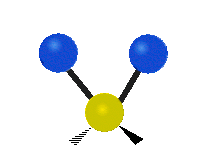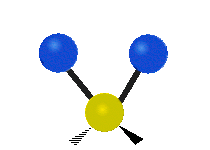
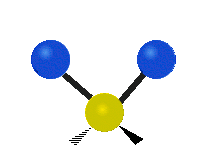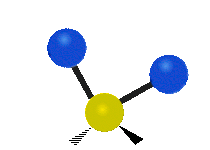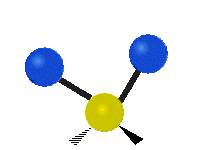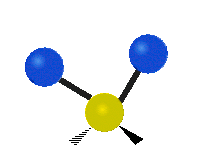
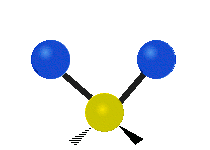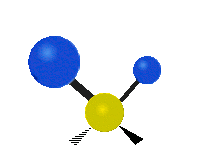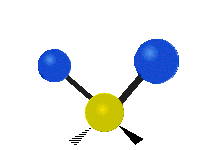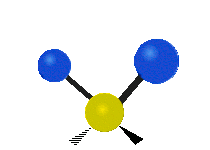
Pokud má molekula více než dva atomy, je situace složitější. Předpokládejme, že se přidá ještě jeden atom, takže nyní máme tři atomy jako ve vodě H2 O, kde jsou oba atomy vodíku připojeny k centrálnímu atomu kyslíku. Vzpomeňte si, že u vodíku šlo o jeden druh roztažení, ale ve vodě jsou dva druhy roztažení a čtyři další druhy vibrací nazývané ohybové vibrace, jak je znázorněno níže.
Atomy ve skupině CH2 nebo v molekulách, jako je voda, mohou vibrovat šesti různými způsoby: symetrickým a antisymetrickým natahováním, nůžkami, kýváním, kýváním a kroucením:
| Symetrické protahování | Antisymetrické protahování | Nůžkový systém |
|
|
|
|
| Houpání | Wagging | Twisting |
|
|
|
|
symetrické protažení: když se dva připojené atomy vzdalují a přibližují k centrálnímu atomu současně.
antisymetrické protažení: Když se dva připojené atomy nevzdalují a nepřibližují k centrálnímu atomu současně.
nůžkový střih: Přesně jak říká název, nůžky se rozevírají, když se dva atomy od sebe vzdalují a přibližují se k sobě.
kolébání: Tento pohyb je jako kyvadlo na hodinách, které se pohybuje sem a tam, jenže zde je kyvadlem atom a místo jednoho jsou tu dva.
vrtění: Pokud člověk zvedne ruku před sebe a položí dva prsty do tvaru písmene "V" a ohne zápěstí směrem k sobě a od sebe. Špičky prstů jsou zde připojené atomy a zápěstí je centrální atom.
kroucení: Tento pohyb je, jako by člověk chodil po běžícím pásu, kde jeho pas je centrálním atomem a nohy jsou dva připojené atomy.
Molekuly s více než třemi atomy
Molekuly s více než třemi atomy jsou ještě složitější a mají ještě více vibrací, které se někdy nazývají "vibrační módy". Každý nový vibrační mód je v podstatě jinou kombinací šesti výše uvedených. Čím více atomů v molekule, tím více způsobů lze kombinovat. Pro většinu molekul s N atomy je počet možných vibrací dané molekuly 3N - 6, zatímco lineární molekuly, neboli molekuly, v nichž jsou atomy v přímce, mají 3N-5 vibračních módů.
Vztah energie a vibrací
Newtonova mechanika
Pomocí newtonovské mechaniky lze vibrace molekuly vypočítat tak, že se na vazby pohlíží jako na pružiny. To je užitečné, protože stejně jako pružina vyžaduje vazba energii k roztažení a také energii ke stlačení. Energie potřebná k roztažení nebo stlačení vazby závisí na tuhosti vazby, která je reprezentována pružinovou konstantou k, a na redukované hmotnosti neboli "středu hmotnosti" dvou atomů připojených na obou koncích označené μ. Vzorec, který se používá k určení energie potřebné k vyvolání kmitů ve vazbě, je následující:
E = h ν = h 2 π k μ . {\displaystyle \ E=h\nu ={h \nad {2\pi }}{\sqrt {k \nad \mu }}.\! }
h: je Planckova konstanta
ν: je frekvence a vyjadřuje rychlost, s jakou se vazba smáčkne a zase rozpojí. Čím je ν větší, tím je tato rychlost rychlejší.
Ε: je energie, která je potřebná k tlačení a tahání vazby.
μ: Redukční hmotnost je součet dvou hmotností atomů a jejich sčítání:
μ = m 1 m 2 m 1 + m 2 . {\displaystyle \mu ={m_{1}m_{2} \nad m_{1}+m_{2}}.\! }
Kvantová mechanika
Při použití kvantové mechaniky je vzorec, který popisuje pružinu, přesně stejný jako ve verzi Newtonovy mechaniky s tím rozdílem, že jsou povoleny pouze určité energie nebo energetické hladiny. Představte si tyto energetické úrovně jako stupně na žebříku, kde člověk může vystoupit nebo sestoupit vždy jen po jedné příčce. Stejně jako tato osoba nemůže stát na prostoru mezi příčkami, tak ani vazba nemůže mít energii mezi energetickými hladinami. Tento nový vzorec se stává:
E n = h ν = h ( n + 1 2 ) 1 2 π k m {\displaystyle E_{n}=h\nu =h\left(n+{1 \nad 2}\right){1 \nad {2\pi }}{\sqrt {k \nad m}}\! } 
kde n je kvantové číslo nebo "energetická hladina", která může nabývat hodnot 0, 1, 2 ... Tvrzení, že energetické hladiny mohou přecházet vždy pouze o jednu hladinu nahoru nebo dolů, je známé jako výběrové pravidlo, které říká, že jediné povolené přechody mezi energetickými hladinami jsou:
Δ n = ± 1 {\displaystyle \Delta n=\pm 1}
kde \Delta n je přechod energie.
Aplikace vibračních pohybů
Když světlo o určité frekvenci dopadne na molekulu, která má vibrace, jejichž pohyb odpovídá stejné frekvenci, pak se světlo pohltí v molekule a energie světla způsobí, že se vazby pohybují v tomto specifickém vibračním pohybu. Kontrolou světla, které se pohltí, mohou vědci zjistit, zda se jedná o určitý druh molekulární vazby, a porovnat ji se seznamem molekul, které tuto vazbu mají.
Některé molekuly, například helium a argon, mají pouze jeden atom a nemají žádné vazby. To znamená, že nepohlcují světlo stejně jako molekuly s více než jedním atomem.
Mezi specifické oblasti chemie, které využívají molekulární vibrace při studiu, patří infračervená spektroskopie (IR) a Ramanova spektroskopie (Raman), přičemž IR spektroskopie se využívá více a má tři vlastní podobory. Tyto podoblasti jsou známy jako blízká IR, střední IR a vzdálená IR spektroskopie. Následuje obecný výčet těchto oborů a aplikací v reálném světě.
Blízká IR: kvantitativní stanovení druhů, jako jsou bílkoviny, tuky, uhlovodíky s nízkou molekulovou hmotností a voda. Dalšího využití se dosahuje v zemědělských produktech, potravinářském, ropném a chemickém průmyslu.
Střední infračervené záření:Nejoblíbenější z infračervených oborů, používá se při určování struktury organických a biochemických sloučenin.
Dálkové infračervené záření: tato oblast je méně populární, i když našla využití v anorganických studiích.
Raman: Ramanova metoda: Používá se ke kvalitativnímu a kvantitativnímu studiu anorganických, organických a biologických systémů, často jako doplňková technika k IR.
Vyhledávání