Thomsonův model atomu
Model švestkového pudinku byl raným (a nesprávným) modelem atomu z 20. století. Navrhl ho J. J. Thomson v roce 1904, po objevu elektronu, ale před objevem atomového jádra. V té době vědci věděli, že v atomu je kladný náboj, který vyrovnává záporné náboje elektronů, takže atom je neutrální, ale nevěděli, odkud se tento kladný náboj bere. Thomsonův model znázorňoval atom, který měl kladně nabité prostředí neboli prostor a záporně nabité elektrony uvnitř tohoto prostředí. Brzy po svém návrhu byl tento model nazván modelem "švestkového pudinku", protože kladné médium připomínalo pudink s elektrony neboli švestkami uvnitř.

Příklad Thomsonova modelu
Vývoj do moderního atomového modelu
Rutherfordův model
V roce 1909, nedlouho po navržení Thomsonova modelu, provedli Hans Geiger a Ernest Marsden pokus s tenkými plátky zlata, aby Thomsonův model ověřili. Jejich profesor Ernest Rutherford očekával, že výsledky potvrdí Thomsonovu pravdu, ale jejich výsledky se od očekávání extrémně lišily. V roce 1911 Rutherford zjistil, že kladné náboje pocházejí z malých částic zvaných protony a že protony jsou v malém centru zvaném jádro a že elektrony obíhají kolem jádra.
Bohrův model
Rutherfordův model byl poměrně jednoduchý, ale chybný, protože elektrony mají náboj a měly by být přitahovány ke kladně nabitému jádru. V roce 1913 Niels Bohr doplnil atomový model o "energetické hladiny". Elektrony nespadnou do jádra, protože jsou obsaženy v energetických hladinách a ke změně na vyšší energetické hladiny je zapotřebí dodatečná energie a ke změně na nižší energetické hladiny je zapotřebí uvolnění energie. Není možné měnit energetické stavy, aniž by se změnila energie elektronu. Pokud elektron zasáhne foton (částice, která je nositelem elektromagnetického záření), získá energii navíc a přejde do vyšší energetické hladiny (změní stav), poté přeskočí zpět do nižší energetické hladiny a uvolní obsaženou energii. Tento nový model byl nazván Bohrův model nebo Rutherfordův-Bohrův model. Tím vznikl zcela nový vědní obor: Kvantová fyzika.
Kvantový model
V roce 1926 Erwin Schrödinger použil myšlenku, že elektrony se chovají jako vlny i částice, což je známé jako vlnově-částicový dualismus. Tím se do atomového modelu a kvantové fyziky dostala zcela nová vrstva. U částice můžete zjistit, kde se v prostoru nachází, pokud ji pozorujete (díváte se na ni). Ale u vlny je všude kolem, takže nemůžete určit, kde přesně se nachází. Tomu se říká kvantová neurčitost. U elektronu můžete znát pouze pravděpodobnost, že se nachází na určitém místě, protože je to vlna i částice. (Viz schéma výše)
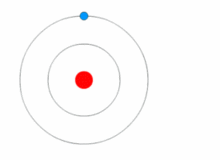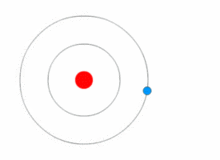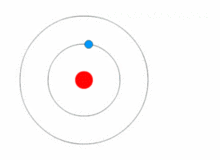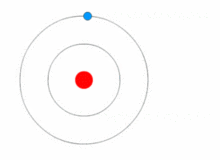
Obrázek znázorňující změnu energetické hladiny elektronu a získávání a uvolňování energie ve formě fotonů.
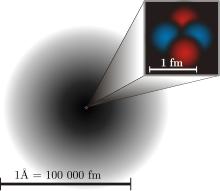
Zobrazí se aktuální atomový model. Černé stínování kolem atomu ukazuje pravděpodobnost, že se v něm nachází elektron. Čím tmavší je, tím větší je šance, že na daném místě elektron najdete.
Související stránky
Vyhledávání